Trump elogia el tratamiento de plasma mientras los investigadores luchan por finalizar los estudios que prueban su eficacia
Katie Thomas y Noah Weiland / The New York Times /
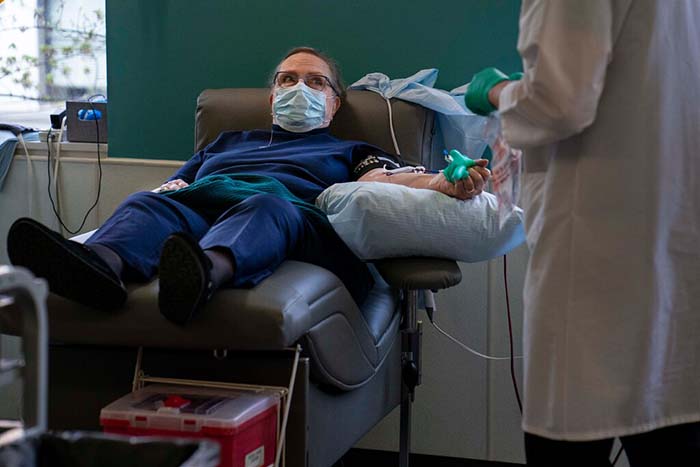
Miles de pacientes de la COVID-19 han sido tratados con plasma sanguíneo de personas que se han recuperado del virus. Sin embargo, el tratamiento aún no ha sido probado en ensayos clínicos rigurosos.
La mañana del 29 de julio, un vuelo de American Airlines despegó desde el Aeropuerto La Guardia en Nueva York con una carga de cien bolsas de plasma sanguíneo donado por sobrevivientes de la COVID-19 con destino a Río de Janeiro.
Científicos estadounidenses tienen la esperanza de que los pacientes de la COVID-19 en Brasil les ayuden a responder una pregunta que lleva sin responder un siglo: ¿Este suero dorado, cargado de anticuerpos contra un patógeno, puede sanar a los enfermos?
La verdad es que nadie sabe si funciona.
Desde abril, el gobierno de Donald Trump ha destinado 48 millones de dólares a un programa con la Clínica Mayo, que ha permitido que más de 53.000 pacientes de la COVID-19 reciban infusiones de plasma. Los médicos y hospitales desesperados por salvar a los pacientes más enfermos se han mostrado ansiosos por probar una terapia que sea segura y posiblemente efectiva. Decenas de miles de personas más ya están inscritas para recibir el tratamiento que ha sido elogiado por todos, desde el presidente hasta el actor Dwayne Johnson, mejor conocido como La Roca.
El 3 de agosto, el presidente Donald Trump promovió su potencial: “Ustedes tuvieron algo muy especial. Tuvieron algo que lo eliminó. Así que queremos ser capaces de usarlo”, declaró, tras instar a los sobrevivientes de COVID-19 que donaran su plasma, al cual se refirió como un “ingrediente hermoso”.
Sin embargo, la demanda inesperada de plasma ha socavado de manera involuntaria las investigaciones que podrían comprobar su eficacia. La única manera de obtener pruebas convincentes es con un ensayo clínico que compare los resultados en pacientes que son elegidos al azar para recibir el tratamiento con los de aquellos que reciben un placebo. Muchos pacientes y sus médicos —a sabiendas de que podrían recibir el tratamiento a través del programa del gobierno— se han mostrado renuentes a participar en los ensayos clínicos que podrían darles un placebo en lugar del plasma.
Los ensayos también se han quedado estancados debido a la disminución de los brotes del virus en muchas ciudades, lo cual dificulta la capacidad de los investigadores de reclutar a personas enfermas. Uno de esos ensayos clínicos, en la Universidad de Columbia, se paralizó luego de que el brote se atenuó en Nueva York. Uno de sus líderes, W. Ian Lipkin, buscó hospitales en otras zonas de alto contagio en Estados Unidos para continuar con la labor de investigación. Pero no encontró muchos interesados.
“Sin un ensayo de control aleatorio, es muy difícil estar seguros de que tenemos algo significativo”, afirmó.
Hasta la semana pasada, solo 67 personas se habían inscrito en el estudio de Columbia, una cifra insuficiente para formular conclusiones estadísticas sólidas. En un último esfuerzo desesperado, el equipo de Lipkin envió el plasma a Brasil, donde la epidemia sigue siendo incontenible.
Ahora, en el punto álgido de una crisis de salud pública, la insistencia del gobierno en ofrecer a pacientes enfermos de gravedad un tratamiento que no se ha probado tan pronto como sea posible tal vez prevalezca a expensas de la finalización de ensayos clínicos que podrían beneficiar a millones de personas en todo el mundo al determinar si estos tratamientos realmente funcionan.
En un comunicado, una vocera de la Administración de Medicamentos y Alimentos (FDA, por su sigla en inglés) declaró que el programa de acceso expandido estaba diseñado para cerrar la brecha hasta que las pruebas pudieran reanudarse y “nunca pretendió sustituir los ensayos de control aleatorio, los cuales son de crucial importancia para comprobar la eficacia del tratamiento”.
La FDA está preparando una autorización de emergencia para usar el tratamiento, según científicos que han sido informados sobre estos planes. La política podría aligerar la carga administrativa que enfrentan los hospitales para la autorización de las transfusiones, lo cual obstaculizaría aún más los ensayos clínicos, según afirmaron los investigadores. Una vocera de la FDA se negó a ofrecer comentarios sobre si esta autorización estaba en proceso.
Esta decisión implicaría que la FDA está “cediendo ante la presión política”, sentenció Luciana Borio, quien supervisó la disposición de salud pública para el Consejo de Seguridad Nacional en el gobierno de Trump y fue científica jefe de la FDA durante el mandato del presidente Barack Obama.
“No me preocupa tanto que los dirigentes políticos adopten un enfoque científico equivocado”, comentó. “Lo que de verdad me inquieta es que los científicos adopten un enfoque científico equivocado”.
El 3 de agosto cuatro excomisionados de la FDA —entre ellos, Scott Gottlieb, quien ocupó el cargo durante el gobierno de Trump— hicieron un llamado a favor de ensayos clínicos más rigurosos para evaluar si el plasma es un tratamiento efectivo para el coronavirus. “Si queremos que esto funcione, tenemos que hacerlo bien”, escribieron.
El plasma convaleciente, el líquido amarillo pálido que queda cuando se eliminan los glóbulos rojos y blancos de la sangre, se ha utilizado desde la década de 1890 en el tratamiento de enfermedades contagiosas como la influenza, el síndrome respiratorio agudo y el ébola. Los científicos creen que podría ser un remedio al proporcionarles a los pacientes enfermos los anticuerpos de quienes se recuperaron de la infección.
Los posibles beneficios del plasma también se promueven en programas de entrevistas conservadores, tal como sucedió con la hidroxicloroquina, un tratamiento para la malaria que Trump enalteció con entusiasmo, pero que no había sido eficaz contra el coronavirus según ensayos clínicos recientes.
A diferencia de la hidroxicloroquina, que conlleva efectos secundarios posiblemente nocivos, el plasma se consideraba seguro y los investigadores médicos más prominentes se habían dispuesto a estudiarlo a medida que los hospitales en Estados Unidos se llenaban de pacientes con la COVID-19.
“Nos encontramos en una crisis médica, no tenemos alternativas”, dijo Arturo Casadevall, microbiólogo de la Universidad Johns Hopkins y presidente del Proyecto Nacional de Plasma Convaleciente para la COVID-19, un consorcio que coordina las investigaciones sobre la terapia.
No obstante, solo se han inscrito unos cuantos cientos de personas en al menos diez ensayos de control aleatorio con placebo en Estados Unidos. Y ahora, a siete meses del inicio de la crisis sanitaria, algunos científicos dicen que el programa de la FDA ha socavado los esfuerzos para obtener respuestas sobre la utilidad del plasma.
“He visto que otras personas lo describen como oro líquido”, dijo Richard Kaufman, director médico del servicio de transfusión en el Hospital Brigham y de la Mujer en Boston, donde es el investigador principal de un ensayo que pretendía reclutar a 220 pacientes, pero solo ha conseguido uno. “Yo diría que tengo mucha incertidumbre en este momento”.
 En el Instituto Pasteur de París, en 1892, le sacan sangre a un caballo para producir suero antidifteria. Foto: Pictorial Press/Alamy.
En el Instituto Pasteur de París, en 1892, le sacan sangre a un caballo para producir suero antidifteria. Foto: Pictorial Press/Alamy.
Un siglo de experimentación
Se ha recurrido a los anticuerpos para curar a los enfermos por lo menos desde la década de 1890, cuando los médicos usaron suero de animales para atender la difteria, una enfermedad bacteriana muy peligrosa. El plasma convaleciente se usó durante la pandemia de influenza de 1918 y la llamada terapia de suero se convirtió en un tratamiento para todo, desde la neumonía hasta el sarampión. En 1925, equipos de perros en trineo viajaron cientos de kilómetros sobre el hielo para entregar suero al pueblo Nome de Alaska, que enfrentaba un brote de difteria.
Aunque cayó en desuso en la década de los cuarenta al descubrirse los antibióticos, el plasma convaleciente a menudo es la primera herramienta a la que recurren los médicos cuando están desesperados por controlar una epidemia emergente.
Así que cuando el coronavirus empezó a propagarse este año, los doctores en Wuhan, China, Irán e Italia voltearon a ver a esta antigua reserva.
El doctor Casadevall se convirtió en uno de los principales defensores en Estados Unidos: escribió en febrero una columna de opinión en el Wall Street Journal y llamó a sus colegas desde la sala de su casa en Baltimore para alentarlos a estudiarlo.
Hacia finales de marzo, en tanto las muertes causadas por el virus aumentaron, el Hospital Mount Sinai en Nueva York y el Houston Methodist en Texas empezaron a hacer transfusiones de plasma a los pacientes.
A medida que el brote se propagaba por Estados Unidos, aumentaron los llamados a favor de expandir la distribución del plasma. Sin embargo, los hospitales podían usar el plasma en una cantidad limitada de pacientes solo si recibían la aprobación de emergencia por parte de la FDA. A partir de marzo, la agencia empezó a recibir llamadas y mensajes todos los días de los doctores de cientos de pacientes que pedían permiso para probar el plasma, según una vocera de la agencia.
Un grupo poco organizado de médicos, que incluye a Casadevall, empezó a solicitar un enfoque más coordinado. El 3 de abril, la FDA y la Clínica Mayo inauguraron el programa de “acceso expandido”, que usaba plasma donado por medio de la Cruz Roja de Estados Unidos.
Extraer plasma es complicado. Comienza de forma muy parecida a la donación de sangre, con una aguja en una vena. La sangre se extrae hacia una máquina con una centrifugadora que filtra el plasma y devuelve el resto de la sangre al cuerpo. El plasma debe almacenarse a temperaturas heladas. Y no puede producirse en masa.
El doctor R. Scott Wright de la Clínica Mayo, que está ayudando a liderar ahí el programa de plasma, dijo que desde el inicio fue un defensor de llevar a cabo estudios aleatorios de plasma convaleciente. Pero la mecánica de organizar grandes estudios se complicó debido a la escasez inicial de plasma, la coordinación por Zoom y la dificultad de predecir a qué lugar del mundo se propagaría después el virus.
Partes desechadas de un kit de aféresis, que separa el plasma de otros componentes de la sangre, después de ser usado con un paciente recuperado de coronavirus que donó sangre en Seattle. Foto: .Lindsey Wasson/Reuters.
Aún así, investigadores en los principales centros médicos del noreste de Estados Unidos empezaron a organizar estudios. La doctora Mila B. Ortigoza, una especialista en enfermedades infecciosas de NYU Langone Health, lanzó una prueba con colegas del Centro Médico Montefiore en apenas unas semanas. Inscribieron a su primer paciente el 17 de abril y condensaron años de trabajo en apenas unos días. Pero para cuando comenzó, la pandemia iba retrocediendo.
“La curva se aplanó aquí en Nueva York”, dijo el doctor Elliot Bennett-Guerrero, líder de otro estudio aleatorio de plasma en Stony Brook Medicine en Long Island. Dijo que el hospital había inscrito a solo 80 de los 500 participantes que se había previsto. Ahora el estudio está pausado.
Y el programa de acceso expandido de la Clínica Mayo se disparó.
“En un inicio, pensamos que se inscribirían 3000 personas”, comentó Michael Joyner, el científico a cargo de la iniciativa. Casadevall se vio tan abrumado por las familias de pacientes que le pedían el plasma que borró su correo electrónico personal del sitio web de Johns Hopkins.
Para junio, 20.000 personas habían recibido el plasma, y el programa publicó un informe prometedor sobre la seguridad del método. Sin embargo, no había un grupo de control para comparar los resultados, así que el estudio no pudo evaluar si el tratamiento era benéfico.
Sin embargo, el tratamiento es ahora más popular que nunca. Alex M. Azar II, secretario de salud y servicios humanos, le dijo a los gobernadores en una llamada el 3 de agosto que la demanda de plasma superaba la oferta.
Los ensayos aleatorios fuera de Estados Unidos tampoco han logrado probar la efectividad del plasma. Un ensayo en siete centros médicos de Wuhan, posiblemente la zona cero del virus, concluyó que el plasma convaleciente no mejoró de manera significativa el tiempo de recuperación de los pacientes.
Como en los ensayos estadounidenses, el estudio de Wuhan tuvo dificultades para reclutar participantes y concluyó anticipadamente con solo 103 voluntarios. Un análisis realizado recientemente por investigadores, entre ellos los doctores Joyner y Casadevall, encontró que varios estudios fuera de Estados Unidos sugerían la efectividad del plasma pero no todos habían sido aleatorizados.
Una reapertura para el presidente Trump
El gobierno de Donald Trump ha retratado el plasma convaleciente como un extraordinario punto positivo en la pandemia.
Ansioso por demostrar que su gobierno se está acercando a una “cura”, Trump ha mencionado el plasma junto con el remdesivir y la dexametasona, dos tratamientos para el coronavirus cuya eficacia se ha demostrado en ensayos aleatorios.
En algún momento, Deborah L. Birx, directora del equipo especial de coronavirus de la Casa Blanca, insistió en que el gobierno federal resguarde 500.000 bolsas de plasma para una posible ola de contagios en el otoño, según un alto funcionario del gobierno. También, dijo el funcionario, presionó para que se hicieran transfusiones de plasma en las casas de retiro.
Al preguntársele sobre estas afirmaciones, un funcionario del grupo de trabajo dijo que la doctora Birx quería proceder con rapidez para aprovechar el periodo posterior a la infección, cuando su plasma contiene un nivel más alto de anticuerpos. Birx dijo que quería que los ensayos clínicos incluyeran a las personas vulnerables en los asilos, añadió el funcionario.
El doctor Stephen M. Hahn, comisionado de la FDA, empezó a comentar los beneficios del plasma en las reuniones informativas de la Casa Blanca en marzo. Después, en entrevistas y audiencia frente al Congreso ha dicho que se trata de una de las pocas terapias que el organismo puede recomendar públicamente.
La semana pasada, dijo que la FDA estaba “entusiasmada por los datos iniciales prometedores que hemos visto” y que la agencia se encontraba “estudiando estos datos para determinar, finalmente, la seguridad y eficacia de este producto”.
Pero añadió que si el plasma “no resulta ser el tratamiento que pensamos que podría ser, recuerden que sus donaciones importan para los Bancos de Sangre de Estados Unidos y la Cruz Roja estadounidense”.
Donación de plasma convaleciente en Inova Blood Services, un banco de sangre en Dulles, Virginia. Foto: Alex Edelman/Agence France-Presse — Getty Images
El tratamiento tiene el respaldo de celebridades como la cantautora Dolly Parton, quien financia un ensayo aleatorizado en el Centro Médico de la Universidad Vanderbilt en Nashville, y Dwayne Johnson, quien grabó un video pidiendo a los sobrevivientes que donen sangre.
“El plasma que está en tu sangre literalmente puede salvar vidas”, dice en el mensaje. “Pero debemos actuar rápido”.
El doctor Joyner dijo que los investigadores de la Clínica Mayo estaban preparándose para publicar un análisis más detallado de los datos que recabaron a través del programa de acceso. Pero dijo que ni él estaba seguro de los planes que tenía la FDA para el programa de acceso extenso.
También existe un esfuerzo, liderado por instituciones médicas de Nueva York, para reunir los datos de los ensayos inconclusos, una estrategia alentada por el doctor Francis Collins, director de los Institutos Nacionales de Salud de Estados Unidos. “Es un enfoque realmente poderoso”, dijo la doctora Liise-anne Pirofski, jefa de enfermedades infecciosas de la facultad de medicina Albert Einstein y el Centro Médico Montefiore, quien lidera el ensayo clínico con la doctora Ortigoza.
Pero la idea no es óptima, dijo el doctor Kaufman del Hospital Brigham and Women. Dijo que no tenía intenciones de participar. “Me preocupa combinar estudios parcialmente terminados que puedan ser realmente distintos”, dijo.
Algunos de los investigadores del ensayo, como Lipkin, han empezado a encontrar nuevos lugares para completar el trabajo. NYU Langone está expandiéndose hacia hospitales en Connecticut, Florida y Texas. Y los investigadores de Johns Hopkins han empezado dos ensayos de plasma convaleciente en personas que aún no están suficientemente graves como para requerir hospitalización, para probar la teoría de que el tratamiento podría funcionar mejor al principio de la infección.
Casadevall dijo que seguía convencido de que los ensayos aleatorizados eran “la única forma en que sabremos si funciona o no”, pero que no deberían oponerse al programa de la Clínica Mayo.
“Estas cosas siempre se pueden conjeturar después”, dijo. “Pero dada la probabilidad de que funcione y dado el antecedente de seguridad, valía la pena intentar darle un uso compasivo. Tal vez puedes hacerlo en una emergencia y de todas formas conseguir algo de datos de eficacia”.
Lipkin admitió que, en retrospectiva, tal vez tuvo algo que ver con la fama que cobró el plasma, por lo que socavó su propia investigación sin darse cuenta. En marzo, apareció en programas de televisión como “Lou Dobbs Tonight” en Fox Business Network, en los que elogió sus beneficios potenciales, un acto que, según él, pudo haber provocado que los funcionarios del gobierno agilizaran la expansión del acceso.
“Tengo algo de responsabilidad en esto”, reconoció. “Creo que se pueden plantear todo tipo de argumentos con base en la historia, cuando se tiene un precedente. Pero eso no sustituye a la ciencia exacta”.
Sheri Fink colaboró con este reportaje desde Houston. Katie Thomas reportó desde Chicago y Noah Weiland, desde Washington.
Plasma tomado de un paciente con coronavirus en el Hospital de Clínicas de Buenos Aires. Foto: Juan Ignacio Roncoroni/EPA vía Shutterstock–
Katie Thomas cubre el negocio de la atención médica, con un enfoque en la industria farmacéutica. Comenzó a trabajar en el Times en 2008 como reportera de deportes. @katie_thomas
Noah Weiland, reportero en la oficina de Washington de The New York Times, cubre atención médica. Creció en East Lansing, Michigan, y se graduó de la Universidad de Chicago. @noahweiland







